 Autour du thème des TIPE pour les concours 2020
Exposé 1
Exposé 2
Exposé 3
Exposé 4
Autour du thème des TIPE pour les concours 2020
Exposé 1
Exposé 2
Exposé 3
Exposé 4
 Autres années
Autour du thème des TIPE pour les concours 2019 - Transports
Autres années
Autour du thème des TIPE pour les concours 2019 - Transports

 Autour du thème des TIPE pour les concours 2020
Exposé 1
Exposé 2
Exposé 3
Exposé 4
Autour du thème des TIPE pour les concours 2020
Exposé 1
Exposé 2
Exposé 3
Exposé 4
 Autres années
Autour du thème des TIPE pour les concours 2019 - Transports
Autres années
Autour du thème des TIPE pour les concours 2019 - Transports
↦ Voir en ligne : Polymerase Exchange During Okazaki Fragment Synthesis Observed in Living Cells
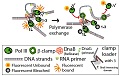
Malgré de très nombreuses études effectuées il reste des questions ouvertes dans la réplication de l’ADN. Une équipe d’Oxford a récemment montré que la réplication chez la bactérie E. coli utilise 3 ADN polymérases et non deux comme on l’a longtemps pensé : une pour chaque brin de la double hélice et une troisième dont le rôle reste à élucider.
Une collaboration entre une équipe du CGM à Gif et une équipe du LPS de l’ENS a permis, grâce à une technique de microscopie de fluorescence très sensible permettant de détecter une seule molécule dans une bactérie, de suivre les échanges des protéines impliquées dans la réplication. Alors que l’on pensait qu’il n’y avait pas d’échanges des polymérases les équipes impliquées ont montré qu’au moins une des trois polymérases est régulièrement échangée avec une polymérase du milieu cellulaire.
La synthèse des deux brins d’une molécule d’ADN ne se fait pas de manière équivalente. Un brin est synthétisé de manière continue alors que l’autre est synthétisé par bouts, appelés fragments d’Okazaki. La synthèse de ces fragments d’Okazaki a pu être suivie de manière indirecte grâce à une protéine qui se fixe sur de l’ADN avant cette synthèse. Les équipes ont montré qu’il existe une forte corrélation temporelle entre cette synthèse et les échanges des polymérases ce qui montre que la polymérase échangée est celle impliquée dans la synthèse des fragments d’Okazaki.
De plus cet échange suggère que la troisième polymérase sert de polymérase « de secours » au cas où une nouvelle polymérase ne viendrait pas remplacer celle qui vient de finir la synthèse du fragment d’Okazaki.
G. Lia, B. Michel, J.F. Allemand, Polymerase Exchange during Okazaki Fragment Synthesis observed in Living Cells, Science, 335, 328 (2012), DOI : 10.1126/science.1210400 ;



 RECRUTEMENT
RECRUTEMENT ACCES DIRECT
ACCES DIRECT